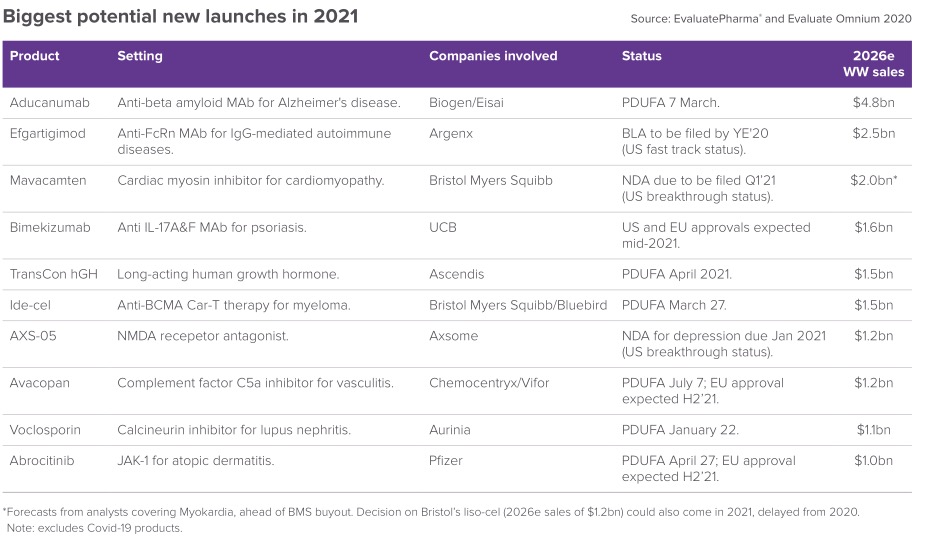
医药市场调研机构近日发布报告,筛选出2021年最有商业潜力的TOP10上市新药,并对其进行了分析。
1. 渤健/卫材:aducanumab
Aducanumab是由渤健与卫材合作开发的一款靶向β淀粉样蛋白的单抗,这是一款备受期待、同时也是备受争议的药物,用于治疗阿尔茨海默氏症(AD)。目前,aducanumab正在接受美国FDA的优先审查,《处方药用户收费法》(PDUFA)目标日期为2021年3月7日。此外,aducanumab也正在接受欧盟、日本的监管审查。
Aducanumab是首个向监管机构提交申请的针对AD相关临床症状衰退和病理机制的生物制剂。在临床试验中,aducanumab已被证实可以去除大脑中的Aβ,并减缓AD和轻度AD痴呆所致轻度认知障碍(MCI)的临床衰退。
如果获批,aducanumab将成为第一个有意义地改变AD进程、减缓AD临床病情下降的治疗方法,同时也是第一个证明去除β淀粉样蛋白可以获得更好临床效果的治疗方法。Evaluate Vantage预测,如果成功上市,aducanumab在2026年的全球销售额将达到48亿美元。
2.Argenx:efgartigimod
Efgartigimod由Argenx开发,是行业领先的抗FcRn项目。该药是一种首创的抗FcRn抗体片段,采用ABDEG技术开发,靶向结合IgG回收受体FcRn,防止IgG的回收,从而使IgG更快耗竭、促进IgG清除。目前,efgartigimod正被开发用于治疗高水平致病性IgG介导的多种严重自身免疫性疾病,如重症肌无力(MG)、原发性免疫性血小板减少症(ITP)、慢性炎症性脱髓鞘性多发性神经病(CIDP)、寻常天疱疮(PV)。
目前,Argenx正在开发efgartigimod静脉制剂和皮下注射制剂。今年5月底,efgartigimod治疗AChR抗体阳性全身性重症肌无力(gMG)关键III期ADAPT研究获得成功。基于该数据,Argenx计划在年底向美国FDA提交efgartigimod静脉制剂的生物制品许可申请(BLA)。
今年11月,Argenx以9800万美元从拜耳手中买进了一张优先审查凭证(PRV)。PRV的持有人可要求FDA对新药上市申请进行优先审查,审查周期会比标准周期缩短4个月时间,从而加速新药批准上市。不过,在公告中,Argenx表示,不会将PRV用于efgartigimod静脉制剂,而是用于皮下注射制剂的审查。业界对该药的市场前景非常看好,Evaluate Vantage预测,efgartigimod上市后,在2026年的全球销售额将达到25亿美元。值得一提的是,efgartigimod也是TOP10榜单中少数几个由小公司开发的药物。
3.MyoKardia:mavacamten
Mavacamten由MyoKardia开发,今年10月,百时美施贵宝以131亿美元、溢价60%将MyoKardia收购。mavacamten是一款创新的口服心肌肌球蛋白别构抑制剂,有潜力减少患者的心脏过度收缩症状。在临床前和临床研究中,mavacamten可降低心壁应激的生物标志物,减轻过度的心肌收缩力和增加舒张顺应性。目前,mavacamten正被开发用于治疗梗阻性和非梗阻性肥厚型心肌病(HCM)以及射血分数保留的心力衰竭(HFpEF)。此前,FDA已授予mavacamten突破性药物资格和孤儿药资格。
今年5月,MyoKardia公布mavacamten治疗症状性梗阻性HCM关键3期EXPLORER-HCM研究的阳性顶线结果。数据显示,该研究达到了主要终点和全部次要终点:与安慰剂组相比,mavacamten治疗组在疾病症状、生活质量、左心室梗阻方面表现出显著改善。
此次收购也是百时美施贵宝继2019年740亿美元收购新基之后的第二大交易,该公司对mavacamten寄予厚望,称该药将成为治疗HCM的一流药物。该公司预计将于2021年第一季度提交美国FDA批准。值得注意的是,此前,MyoKardia和联拓生物(LianBio)已建立战略合作伙伴关系,将共同在大中华地区开发和商业化mavacamten。Evaluate Vantage预测,mavacamten上市后,在2026年的全球销售额将达到20亿美元。
4.优时比:bimekizumab
Bimekizumab是由优时比开发的一款具有双重作用机制的独特分子,可同时强效、选择性地中和IL-17A和IL-17F,这是驱动炎症过程的2种关键细胞因子。IL-17A和IL-17F具有相似的促炎功能,并独立地与其他炎症介质合作,在多个组织中驱动慢性炎症和损害。目前,bimekizumab正被评估治疗多种炎症性疾病,包括:斑块型银屑病、银屑病关节炎、强直性脊柱炎、非放射学中轴型脊柱关节炎。
Bimekizumab独特的IL-17A/IL-17F双重中和有潜力为治疗免疫介导的炎症性疾病提供一种新的靶向疗法。在治疗中重度斑块型银屑病的3期临床试验中,bimekizumab疗效超越了艾伯维Humira、诺华Cosentyx、强生Stelara。
今年9月,bimekizumab治疗斑块型银屑病的上市申请获美国FDA和欧盟EMA受理,预计2021年年中获得批准。Evaluate Vantage预测,bimekizumab上市后,在2026年的全球销售额将达到16亿美元。
5. Ascendis Pharma:TransCon hGH
TransCon hGH由Ascendis Pharma开发,这是一种人生长激素(hGH)长效前药,每周给药一次,用于治疗儿童生长激素缺乏症(GHD)。今年9月,TransCon hGH的生物制品许可申请获美国FDA受理,PDUFA目标日期为2021年6月25日。今年11月,欧洲药品管理局也受理了TransCon hGH的营销授权申请。
TransCon hGH是全球唯一采用“瞬时连接(Transient Conjugation)”专利技术设计的人生长激素前药,有别于其它技术的长效生长激素类似物,可以保证在人体内持续7天释放未经修饰的、具有活性的人生长激素,并且确保具有活性的人生长激素在体内的组织分布和每日一次的重组生长激素(rhGH)保持一致 。在美国和欧洲,TransCon hGH均被授予了治疗GHD的孤儿药资格(ODD)。
目前,尚无治疗儿童GHD的长效生长激素。如果获得批准,TransCon hGH将成为第一个治疗儿童GHD的长效生长激素疗法。值得注意的是,在2018年,Ascendis与维梧资本合资建立维昇药业,致力于将Ascendis旗下内分泌罕见病治疗方案在大中华区进行开发及推广。去年10月,TransCon hGH获批在中国开展治疗儿童GHD的III期临床研究。TransCon hGH有潜力成为中国首个未经修饰的长效人生长激素。Evaluate Vantage预测,TransCon hGH上市后,在2026年的全球销售额将达到15亿美元。
6. BMS/蓝鸟生物:ide-cel
Ide-cel由百时美施贵宝与蓝鸟生物合作开发,这是一款B细胞成熟抗原(BCMA)导向的嵌合抗原受体(CAR)T细胞疗法,开发用于治疗多发性骨髓瘤(MM)。目前,ide-cel正在接受美国FDA的优先审查,PUDFA目标日期2021年3月27日,该药同时也在接受欧盟EMA的加速评估,治疗适应症为:用于既往接受至少三种疗法(包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)的复发性/难治性(R/R)MM)成人。在美国和欧盟,ide-cel分别被授予了突破性药物资格(BTD)和优先药物资格(PRIME)。
Ide-cel是全球第一个进入监管审查程序的BCMA CAR-T细胞疗法,其原理是在患者的T细胞上嵌合BCMA的受体,其制备过程为:从每例患者的血液中分离获得T细胞,使用编码BCMA抗原受体的慢病毒载体对T细胞进行修饰,使T细胞表面表达BCMA受体。治疗时,MM患者先接受2种化疗药物(环磷酰胺和氟达拉滨)预处理,杀死体内现有T细胞,随后输注ide-cel,一旦输注回患者体内,ide-cel开始寻找并杀死表达BCMA的细胞。
如果获得批准,ide-cel将成为第一款上市的BCMA CAR-T细胞疗法。Evaluate Vantage预测,ide-cel在2026年的全球销售额将达到15亿美元。目前,百时美施贵宝还有一款自体CD19 CAR-T细胞疗法liso-cel正在接受美国FDA的审查,但在今年11月,FDA表示无法在PDUFA目标日期2020年11月16日前完成审查,原因是COVID大流行导致无法对liso-cel的第三方生产设施进行检查。FDA并没有提供新的PDUFA日期,因此,liso-cel有可能在2021年获批上市,Evaluate Vantage预测,liso-cel在2026年的全球销售额将达到12亿美元。
7.Axsome Therapeutics:AXS-05
AXS-05(右美沙芬/安非他酮调释片)由Axsome Therapeutics开发,该药是一种新型口服N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,具有多模式活性,开发用于治疗抑郁症和其他中枢神经系统(CNS)疾病。AXS-05由右美沙芬和安非他酮的专有配方和剂量组成,并采用了Axsome专有的代谢抑制技术。
AXS-05中的右美沙芬组分是一种非竞争性NMDA受体拮抗剂,也被称为谷氨酸受体调节剂,这是一种新的作用机制,与目前可用的大多数抑郁症药物不同。AXS-05中的安非他酮成分可提高右美沙芬的生物利用度。此前,AXS-05已获得美国FDA授予2个突破性药物资格:一个是治疗重度抑郁症(MDD),另一个是治疗阿尔茨海默氏症(AD)激越。
在治疗MDD的III期临床研究中,与安慰剂组相比,AXS-05组抑郁症状表现出实质性、快速、统计学上显著意义的减少。本月初公布的临床研究数据还显示,有自杀意念的MDD患者,在接受AXS-05治疗后自杀意念迅速消失:MADRS自杀项评分在治疗第1周降低68%、到第4周降低82%;此外,到治疗第1周和第4周,分别有60%、78%的患者自杀意念完全消除。AXS-05是一款具有突破性意义的药物,Evaluate Vantage预测,该药上市后,在2026年的全球销售额将达到12亿美元。
8.Vifor/ChemoCentryx:avacopan
Avacopan由Vifor与ChemoCentryx合作开发,该药是一种口服、选择性补体C5a受体(C5aR1)抑制剂,开发用于治疗血管炎。今年9月,avacopan治疗抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(肉芽肿伴多发性血管炎和显微镜下多血管炎)的新药申请获美国FDA受理,PDUFA目标日期为2021年7月7日。今年11月,avacopan的营销授权申请也获欧盟EMA受理。
通过精确地阻断破坏性炎症细胞表面存在的促炎性补体系统片段C5a受体,avacopan可阻止这些细胞对C5a激活作出损害的能力,而C5a激活是ANCA相关血管炎的驱动因素。avacopan旨在有效控制炎症性血管炎过程,防止复发,同时降低治疗相关损害的风险。此外,avacopan仅针对C5aR1的选择性抑制作用使C5a I通路可通过C5L2受体正常工作。
来自全球关键3期ADVOCATE研究的数据显示,与泼尼松组相比,avacopan组在第52周持续缓解方面有统计学优势,糖皮质激素毒性显著降低、肾功能获得更大改善、与健康相关的生活质量也有较大改善。如果获得批准,avacopan将成为治疗ANCA相关血管炎的第一个口服、选择性补体C5a受体抑制剂。Evaluate Vantage预测,avacopan上市后,在2026年的全球销售额将达到12亿美元。
9.Aurinia:voclosporin
Voclosporin是由Aurinia开发的一种新型、潜在同类最佳钙调神经磷酸酶抑制剂(CNI),该药是一种免疫抑制剂,具有协同和双重作用机制。 Voclosporin通过抑制钙调神经磷酸酶(CN),阻断IL-2的表达和T细胞介导的免疫反应,稳定肾脏足细胞(podocyte)。与传统的CNI相比,voclosporin具有更加可预测的药代动力学和药效学关系(可能不需要治疗药物监测)、效力增加(与环孢素a相比)和代谢谱改善。
目前,该药治疗狼疮性肾炎(LN)的新药申请正在接受美国FDA的优先审查,PDUFA目标日期为2021年1月22日。来自关键III期AURORA研究的数据显示,与安慰剂相比,voclosporin显著改善了LN患者的近期和长期预后:显著提高肾脏缓解率、在所有预先指定的分层次要终点方面有统计学意义的显著改善。
如果获得批准,voclosporin有潜力成为FDA批准的第一个治疗狼疮性肾炎(LN)的药物。Evaluate Vantage预测,voclosporin上市后,在2026年的全球销售额将达到11亿美元。
10.辉瑞:abrocitinib
Abrocitinib是由辉瑞开发的一种JAK1抑制剂,目前,该药治疗≥12岁中度至重度特应性皮炎患者的新药申请正在接受美国FDA的优先审查,PDUFA目标日期为2021年4月。此外,abrocitinib也正在接受欧盟EMA的审查,预计2021年下半年获批。
abrocitinib是一种口服小分子,可选择性地抑制Janus激酶1(JAK1)。抑制JAK1被认为可调节特应性皮炎病理生理过程中的多种细胞因子,包括IL-4、IL-13、IL-31和干扰素γ。此前,FDA已授予abrocitinib治疗中重度特应性皮炎的突破性药物资格。
在JADE III期临床项目中,abrocitinib在缓解疾病症状和体征方面表现出显著疗效,包括迅速减轻瘙痒。特别值得一提的是,在III期JADE COMPARE研究中,200mg剂量abrocitinib在关键次要终点(第2周瘙痒显著减轻的患者比例)方面在统计学上优于赛诺菲/再生元的重磅生物制剂Dupixent。如果获得批准,abrocitinib将为中重度特应性皮炎患者群体提供一种重要的口服治疗选择。Evaluate Vantage预测,abrocitinib上市后,在2026年的全球销售额将达到10亿美元。
原内容参考来源:Evaluate Vantage:2021 Preview.